Transaktinoid içeren en karmaşık kimyasal bileşik olan Seaborgium heksakarbonil sentezlendi. Basit ve karmaşık maddeler. Allotropi. Kimyasal bileşikler ve karışımlar Kimyadaki tüm karmaşık maddeler
Tüm maddeler basit ve karmaşık olarak ikiye ayrılır.
Basit maddeler- Bunlar bir elementin atomlarından oluşan maddelerdir.
Bazı basit maddelerde aynı elementin atomları birleşerek molekülleri oluşturur. Bu kadar basit maddelerin moleküler yapı. Bunlar şunları içerir: , . Bütün bu maddeler diatomik moleküllerden oluşur. (Basit maddelerin adlarının elementlerin adlarıyla aynı olduğuna dikkat edin!)
Diğer basit maddeler atomik yapı yani aralarında belirli bağların bulunduğu atomlardan oluşurlar. Bu tür basit maddelere örnek olarak hepsi (vb.) ve bazıları (vb.) gösterilebilir. Bu basit maddelerin sadece isimleri değil formülleri de elementlerin sembolleriyle örtüşmektedir.
Ayrıca basit maddeler adı verilen bir grup da vardır. Bunlar şunları içerir: helyum He, neon Ne, argon Ar, kripton Kr, ksenon Xe, radon Rn. Bu basit maddeler birbirine bağlı olmayan atomlardan oluşur.
Her element en az bir basit madde oluşturur. Bazı elementler bir değil iki veya daha fazla basit madde oluşturabilir. Bu olaya allotropi denir.
Allotropi tek bir elementin birden fazla basit madde oluşturması olgusudur.
Aynı kimyasal elementin oluşturduğu farklı basit maddelere allotropik modifikasyonlar denir.
Allotropik modifikasyonlar moleküler bileşim açısından birbirinden farklı olabilir. Örneğin oksijen elementi iki basit maddeyi oluşturur. Bunlardan biri iki atomlu O2 moleküllerinden oluşur ve element- ile aynı adı taşır. Başka bir basit madde, triatomik O3 moleküllerinden oluşur ve kendi adı olan ozondur.
Oksijen O 2 ve ozon O 3 farklı fiziksel ve kimyasal özelliklere sahiptir.
Allotropik modifikasyonlar, farklı kristal yapılara sahip katılar olabilir. Bir örnek, karbon C - elmas ve grafitin allotropik modifikasyonlarıdır.
Bilinen basit maddelerin sayısı (yaklaşık 400), kimyasal elementlerin sayısından önemli ölçüde daha fazladır, çünkü birçok element iki veya daha fazla allotropik modifikasyon oluşturabilir.
Karmaşık maddeler- Bunlar farklı elementlerin atomlarından oluşan maddelerdir.
Karmaşık madde örnekleri: HCl, H20, NaCl, C02, H2S04, vb.
Karmaşık maddelere genellikle kimyasal bileşikler denir. Kimyasal bileşiklerde bu bileşiklerin oluşturulduğu basit maddelerin özellikleri korunmaz. Karmaşık bir maddenin özellikleri, kendisini oluşturan basit maddelerin özelliklerinden farklıdır.
Örneğin, sodyum klorür NaCl basit maddelerden (metalik sodyum Na ve gaz halindeki klor Cl) oluşturulabilir. NaCl'nin fiziksel ve kimyasal özellikleri, Na ve Cl2'nin özelliklerinden farklıdır.
Doğada kural olarak saf maddeler değil, maddelerin karışımları vardır. Pratik faaliyetlerde genellikle madde karışımlarını da kullanırız. Herhangi bir karışım, adı verilen iki veya daha fazla maddeden oluşur. karışım bileşenleri.
Örneğin hava, birkaç gaz halindeki maddenin bir karışımıdır: oksijen O2 (hacimce %21), (%78) vb. Karışımlar birçok maddenin, bazı metallerin alaşımlarının vb. çözeltileridir.
Maddelerin karışımları homojen (homojen) ve heterojendir (heterojen).
Homojen karışımlar- bunlar bileşenler arasında arayüz bulunmayan karışımlardır.
Gazların (özellikle hava) ve sıvı çözeltilerin (örneğin, sudaki şeker çözeltisi) karışımları homojendir.
Heterojen karışımlar- Bileşenlerin bir arayüzle ayrıldığı karışımlardır.
Heterojen, katı karışımlarını (kum + tebeşir tozu), birbiri içinde çözünmeyen sıvı karışımlarını (su + yağ), içinde çözünmeyen sıvı ve katı karışımlarını (su + tebeşir) içerir.
Karışımlar ve kimyasal bileşikler arasındaki en önemli farklar:
- Karışımlarda bireysel maddelerin (bileşenlerin) özellikleri korunur.
- Karışımların bileşimi sabit değildir.
Bilim adamlarından oluşan uluslararası bir ekip, atom numarası 106 olan kararsız bir element ile karbon monoksitin bir bileşiği olan seaborgiyum hekzakarbonil Sg(CO)6'yı sentezledi ve inceledi ve ayrıca bunu, seaborgiyumun homologları olan molibden ve tungstenin kararsız izotoplarının benzer bileşikleriyle karşılaştırdı. . Bu, bir transaktinoid, yani atom numarası 103'ün üzerinde olan bir element içeren, deneysel olarak elde edilen en karmaşık kimyasal bileşiktir. Transaktinoidlerin kimyasal özelliklerinde, görelilik teorisinin iç elektronlar üzerindeki etkileri en belirgindir, bu nedenle Transaktinoidlerin kimyasının incelenmesi, ağır atomların elektronik yapısının hesaplanmasına ilişkin tüm teorinin açıklığa kavuşturulmasını mümkün kılar.
Kimyasal elementlerin periyodik tablosu zaten 118 numaraya kadar doldurulmuştur (Şekil 1). Tüm yapısı, elektronik kabukların kademeli olarak doldurulmasıyla ortaya çıkan artan atom numarasına sahip elementlerin kimyasal özelliklerinin periyodikliğini yansıtır. İki kimyasal elementin tamamen dolu iç elektron kabuklarının sayısı farklıysa ancak kimyasal bağdan sorumlu olan benzer dış elektronlara sahipse, bu durumda iki elementin benzer kimyasal özelliklere sahip olması gerekir. Bu element serilerine birbirlerinin homologları denir ve periyodik tabloda aynı grupta, üst üste yer alırlar. Örneğin, altıncı grubu oluşturan geçiş metalleri (krom, molibden, tungsten ve 106 numaralı süper ağır element seaborgiyum) birbirlerinin homologlarıdır. Bunlardan ilk üçünün kimyasal özellikleri uzun zamandır biliniyorken, seaborgiyumun kimyası henüz yeni araştırılmaya başlandı. Ancak periyodik tabloya göre kimyasal özelliklerinin benzer olması beklenebilir.
Homolog elementlerin kimyasal özelliklerini karşılaştırırken önemli bir tuzak vardır. Ağır atomlarda iç elektronlar ışığa yakın hızlarda hareket eder ve bu nedenle görelilik teorisinin etkileri sonuna kadar çalışır. Bunlar, s- ve p-orbitallerinin daha fazla sıkıştırılmasına ve bunun sonucunda da dış elektron bulutlarının bir miktar genişlemesine yol açar. Büyük bir nükleer yük aynı zamanda spin-yörünge bölünmesi gibi elektronların birbirleriyle etkileşime girmesinin etkilerini de artırır. Bütün bunlar ağır bir atomun belirli komşularla kimyasal bağını etkiler. Ve modern teorik kimyanın tüm bu etkileri doğru bir şekilde hesaplayabilmesi gerekiyor.
Atom ne kadar ağırsa, görelilik etkileri de o kadar güçlü olur. Teorik hesaplamaları test etmek için bilinen en ağır element olan transaktinoidlerin yani atom numarası 103'ün üzerinde olan elementlerin kullanılması doğal görünmektedir (Şekil 1). Ancak deneysel çalışmalarına giden yolda bazı önemli zorluklar ortaya çıkıyor.
İlk olarak, transaktinoid elementlerin atom çekirdekleri çok kararsızdır; tipik ömürleri dakikalar, saniyeler ve hatta saniyenin kesirleridir. Bu nedenle makroskobik miktarda maddenin birikmesinden söz edilmiyor, tek tek atomlarla doğumlarından hemen sonra çalışmalıyız.
İkinci zorluk olmasaydı bu büyük bir sorun olmazdı: Bu atomlar ancak parça miktarları. Süper ağır atomlar, nükleer reaksiyonlarda, diğer iki oldukça ağır atomun büyük miktarda nötron içeriğiyle birleştirilmesi sürecinde sentezlenir. Bunu yapmak için, bir türden ağır iyonlardan oluşan bir ışın, başka türden ağır atomlar içeren bir hedefe yönlendirilir ve çarpıştıklarında nükleer reaksiyonlar meydana gelir. Vakaların ezici çoğunluğunda, yalnızca daha küçük parçalar üretirler ve yalnızca ara sıra, istenen süper ağır çekirdeğin iki çekirdeğin birleşmesinden doğduğu görülür. Sonuç olarak, bir hedefin sürekli ışınlanması sırasında süper ağır çekirdeklerin üretim hızının gülünç derecede düşük olduğu ortaya çıkıyor: Dakikada, saatte, günde ve hatta haftada bir tane civarında.
Bu doğum teknolojisi üçüncü bir soruna yol açıyor. Süper ağır atomların sentezi, hedefe çarpan bir ışından gelen sürekli sert radyasyon koşulları altında ve bunun sonucunda büyük miktarda yabancı nükleer enkaz akışının varlığında meydana gelir. İstenilen çekirdek doğsa, çevreden elektronlar alsa, gerçek bir atom haline gelse ve sonunda hedefin hemen arkasında yeni bir bileşiğin oluşmasıyla kimyasal reaksiyona girse bile - bu bileşik zorlu radyasyon koşullarında olacaktır. Sert iyonlaşmanın neden olduğu plazma ile sürekli temas Bu koşullar altında, transaktinoidlerin flerovyuma (element 114) kadar bazı kimyalarının incelenmesinin genellikle mümkün olması, başlı başına büyük bir başarıdır. Bununla birlikte, şimdiye kadar transaktinoidleri içeren tüm kimyasal bileşikler, kimyasal açıdan çok basitti; halojenürler, oksitler ve maksimum oksidasyon durumunda ağır bir atoma sahip diğer benzer bileşikler. Önemsiz olmayan kimyasal bağlara sahip daha kırılgan kimyasal bileşikler, sert radyasyonun varlığında hızla yok edilir. Ve ne yazık ki tüm bunlar, transaktinoidlerin kimyasal özelliklerinin test edilmesini zorlaştırıyor.
Geçen gün bir dergide Bilim"önemsiz olmayan" transaktinoid kimyanın başlangıcını işaret ederek yayınlandı. Sg(CO)6 bileşiği, seaborgiyum heksakarbonil'in sentezini ve deneysel çalışmasını rapor etmektedir (Şekil 2). Ayrıca, aynı düzenekte ve aynı yöntemlerle, homolog elementler seaborgiyum, Mo(CO) 6 ve W(CO) 6'nın heksakarbonil kompleksleri de incelendi ve yarılanma ömrü birkaç saniye veya dakika.
Bu çalışmanın en önemli özelliği, son on yılın çeşitli teknik ilerlemelerini bir araya getiren birleşik bir deney düzeneğidir. Bu kurulum yukarıda belirtilen sorunların üçüncüsünün üstesinden gelir - süper ağır çekirdeklerin sentez alanını ve ortaya çıkan bileşiğin fizikokimyasal araştırma alanını mekansal olarak ayırır. Genel görünümü Şekil 2'de gösterilmektedir. 3. Kurulumun girişinde (şeklin arka planında sağdan sola), bir çekirdek ışını hedefle etkileşime girer ve ikincil çekirdeklerden oluşan bir "kokteyl" oluşturur. Reaksiyon ürünleri, çift kutuplu bir manyetik alan (şekilde D elemanı) tarafından ve çekirdeğin farklı yük ve kütle oranları için farklı şekillerde saptırılır. Manyetik alanın büyüklüğü, yalnızca incelenen çekirdeklerin manyetik mercekler sisteminden (Q) geçeceği, arka plandaki çekirdeklerin ve orijinal ışının saptırılacağı şekilde hesaplanır. Temelde bu teknik, çekirdeklere uygulanan iyi bilinen kütle spektrometresinin kopyasıdır.
Bir sonraki adımda, ayrılan çekirdekler (Sg, Mo veya W), içinden helyum ve karbon monoksitten oluşan bir gaz karışımının üflendiği RTC odasına girer. Önemli bir nokta: Odaya girerken çekirdekler, mylar'dan yapılmış, kesin olarak tanımlanmış kalınlıktaki bir pencereden geçer. Sıcak çekirdeklerin kinetik enerjisini sönümler ve gaz odası içinde termalleşmelerini (moleküllerin termal hareket enerjisine kadar yavaşlamalarını) sağlar. Orada çekirdekler "elektronlarla giyinir" ve karbon monoksit ile kimyasal reaksiyona girerek bir bileşik - bir karbonil kompleksi oluşturur. Bileşik uçucu olduğundan, tüm gaz akışıyla birlikte 10 metrelik bir Teflon kılcal boru yoluyla kurulumun ikinci kısmına, özel bir COMPACT analizörüne aktarılır.
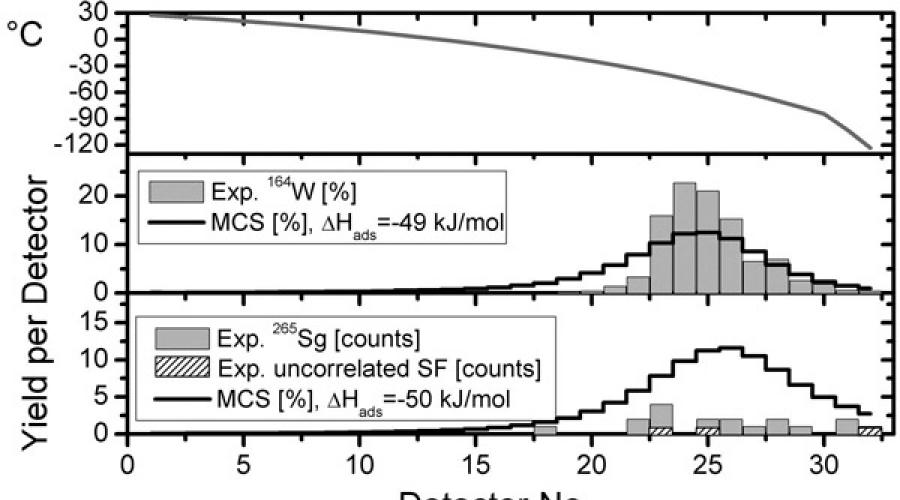
KOMPAKT isminin açılımı Transaktinoidlerin Fiziği ve Kimyası için Cryo-Online Çoklu Dedektör. Bu kurulum, kararsız element bileşiklerinin gaz termokromatografisi için 32 çift yarı iletken dedektörden oluşan bir seridir. Hat boyunca güçlü bir sıcaklık gradyanı yaratılır: her bir dedektör çifti, hattın başında +30°C'den sonunda -120°C'ye kadar kendi sıcaklığındadır. Her dedektör, çekirdeklerden bozunum sırasında yayılan α ve β parçacıklarını kaydedip, enerjilerini ve ayrılma zamanlarını yüksek doğrulukla ölçebilmektedir. Bu, seaborgiyum çekirdeklerini, belirli enerjilerdeki alfa parçacıklarının birbiri ardına yayıldığı karakteristik bozunma zincirleriyle tanımlamak ve bu nadir olayları arka plandaki süreçlerle karıştırmamak için gereklidir.
COMPACT analizörü bu şekilde çalışır. Gaz karışımı cetvelden geçirildiğinde, ağır metalin karbonil kompleksinin molekülleri, radyoaktif bozunumdan sonra kaydedildikleri belirli bir dedektörün yüzeyinde biriktirilir. Bozunmanın kaydedildiği dedektörün sayısı, molekülün emiliminin enerjik olarak uygun hale geldiği sıcaklığı gösterir. Bu sıcaklık, incelenen karbonil kompleksinin fizikokimyasal özellikleri (adsorpsiyon entalpisi) tarafından belirlenir. Maddenin bu özelliği de, göreceli etkilerin önemli bir rol oynadığı kimyasal hesaplamalarla tahmin ediliyor. Böylece Sg(CO)6, W(CO)6 ve Mo(CO)6'nın COMPACT analiz cihazında nasıl biriktiğinin ölçülmesiyle kimyasal teorik hesaplamalar doğrulanabilir ve bu türlerin adsorpsiyon entalpisi ölçülebilir.

Bu çalışmanın sonuçları Şekil 2'de gösterilmektedir. 4. Burada 32 çift dedektörün her birinde çeşitli özellikler verilmiştir. Üstteki grafik basitçe bir cetvel boyunca sıcaklık dağılımıdır. Orta ve alt grafikler aslında deneysel verileri gösteriyor - tungsten-164 (ortada) ve seaborgiyum-265 (altta) çekirdeklerinin dedektörler arasında kaydedilen bozunumlarının dağılımı. Elbette burada seaborgium ile ilgili yeterli olay yok - hedefin iki hafta boyunca yoğun bir ışınla sürekli ışınlanmasıyla toplam 18 olay kaydedildi. Ancak yine de, 20'nin üzerindeki sayılara sahip dedektörlerde bunların çizgi boyunca eşit şekilde dağılmadıkları, ancak sonuna daha yakın oldukları açıkça görülmektedir. Bu süreç, oldukça yakın zamanda hesaplanan adsorpsiyon entalpisi ile modellenirken yaklaşık olarak aynı resim elde edildi. sadece bu maddelere yönelik teorik bir çalışma. Kararsız bir tungsten izotopuna ve molibden izotoplarına sahip bileşikler için de benzer bir tablo gözlemlenir (bunlar şekilde gösterilmemiştir): dağılımların maksimumu tam olarak teorik hesaplamaların öngördüğü yere düşer. Bu tesadüf, ağır atomların yapısının tamamen göreli olarak hesaplanmasına yönelik modern yöntemlerin deneysel verileri yeterince açıkladığı konusunda ek bir güven sağlar.
Son olarak bu araştırmaya kuşbakışı bakmakta fayda var. Tipik olarak kararsız süper ağır elementler, nükleer fizikte yeni bilgiler edinmek adına fizikçilerin ilgisini çekmektedir. Ancak doğa bize izin verdiği için bu unsurlar başka bir amaç için de kullanılabilir: ne kadar iyi tahminde bulunabileceğimizi test etmek için. kimyasal Bu tür atomların özellikleri. Bu bilgiye ise kendi başına değil, ağır atomların elektronik yapılarının göreceli etkileri dikkate alarak hesaplanmasına ilişkin tüm modern teorinin ek bir testi olarak ihtiyacımız var. Ve buradan, tamamen uygulamalı araştırmalardan gerçek temel bilime kadar çok sayıda uygulama gelir. Transaktinoidlerin kimyası, fiziğin çok çeşitli alanlarının ve ilgili disiplinlerin ne kadar güçlü bir şekilde birbirine bağlı olduğunu bir kez daha vurgulamaktadır.
Farklı şekiller. Kimyasal reaksiyonlarda başka birçok maddeyi oluşturmak üzere ayrışabilirler ve daha az karmaşık birkaç maddeden de oluşturulabilirler. Örneğin su oksijen ve hidrojen atomlarından, demir sülfür ise demir ve kükürt atomlarından oluşur.
Notlar
Ayrıca bakınız
Bağlantılar
Wikimedia Vakfı. 2010.
Diğer sözlüklerde “Karmaşık maddeler” in neler olduğuna bakın:
Nihai ürünlerin başlangıç ürünlerinden ara maddeler yoluyla elde edildiği kimyasal reaksiyonlar. Ara maddelerin her birinin oluşumuna karmaşık bir reaksiyonun temel aşaması denir. Karmaşık reaksiyonlar, örneğin zincir reaksiyonlarını içerir... Büyük Ansiklopedik Sözlük
Karbonik asit esteri. R ve R herhangi bir alkil veya aril grubunu belirtir Oksoasitlerden (hem karboksilik hem de mineral) türetilen esterler Rk ... Vikipedi
Tiyoesterlerin genel yapısı Tiyoesterler, C S CO C fonksiyonel grubunu içeren organik bileşiklerdir ve tiyollerin ve karbonhidratların esterleridir ... Wikipedia
Nihai ürünlerin başlangıç ürünlerinden ara maddeler yoluyla elde edildiği kimyasal reaksiyonlar. Ara maddelerin her birinin oluşumuna karmaşık reaksiyonların temel aşaması denir. Karmaşık reaksiyonlar örneğin zincirleme... ... ansiklopedik sözlük
Bu tür reaksiyonlar kimyasaldır ve temel eylemleri farklıdır. S. r.'nin aksine. Basit reaksiyonların temel eylemleri, içerdikleri maddelerin doğası gereği birbirinden farklı değildir, ancak belki de yalnızca dönüşümün yönü açısından farklılık gösterir, eğer... ... Büyük Sovyet Ansiklopedisi
- (proteidler, holoproteinler) peptit zincirlerine (basit protein) ek olarak amino asit olmayan bir bileşen, bir protez grubu içeren iki bileşenli proteinler. Serbest amino asitlere ek olarak karmaşık proteinlerin hidrolizi sırasında ... ... Wikipedia
Karbon elmasının allotropik modifikasyonu (ana kayada) Basit maddeler yalnızca bir kimyasal elementin atomlarından oluşan maddeler (homonükleilerden ... Vikipedi)
İnorganik maddeler, organik olmayan, yani karbon içermeyen kimyasal maddelerdir (karbürler, siyanürler, karbonatlar, karbon oksitler ve geleneksel olarak sınıflandırılan diğer bazı bileşikler hariç ... ... Wikipedia
yüksek saflıkta maddeler- basit (kimyasal elementler) ve karmaşık maddeler, ağırlıkça 10 6'dan 10 8'e kadar safsızlıklar içerir. %, ancak ≤10 3 ağırlık. %. Bu tür maddeler yarı iletken endüstrisinde, nükleer enerjide, fiber optikte önemli bir rol oynamaktadır... Ansiklopedik Metalurji Sözlüğü
ESTERLER, ALKOLLER ve ASİTLER arasındaki reaksiyon sonucu oluşan organik bileşikler sınıfından maddeler... Bilimsel ve teknik ansiklopedik sözlük
Kitabın
- Denizdeki maddenin aktarım ve dönüşüm süreçlerinin modellenmesi. Monografi, Leningrad Üniversitesi Yayınevi tarafından yayınlanan “Deniz ekolojik sistemlerinin matematiksel modellenmesi” kitap serisine devam ediyor. İlk iki kitap...
- Kimya testleri, 8. sınıf Maddelerde meydana gelen değişiklikler Çözünme Çözeltileri İyon değişim reaksiyonları ve redoks reaksiyonları O. S. Gabrielyan Kimya, 8. sınıf, Ryabov M. ders kitabına. Kılavuz, O. S. Gabrielyan'ın "Kimya. 8. Sınıf" ders kitabındaki konuları kapsayan testleri içerir: "Maddelerde meydana gelen değişiklikler", "Çözünme. Çözümler. İyon değişim reaksiyonları ve...
Çevremizdeki dünya maddidir. Maddenin iki türü vardır: madde ve alan. Kimyanın amacı bir maddedir (çeşitli alanların madde üzerindeki etkisi dahil - ses, manyetik, elektromanyetik vb.)
Madde, hareketsiz kütlesi olan her şeydir (yani, hareket etmediğinde kütlenin varlığıyla karakterize edilir). Yani, bir elektronun geri kalan kütlesi (hareket etmeyen bir elektronun kütlesi) çok küçük olmasına rağmen - yaklaşık 10-27 g, ancak bir elektron bile maddedir.
Madde gaz, sıvı ve katı olmak üzere üç toplanma halinde bulunur. Maddenin başka bir durumu daha var - plazma (örneğin, fırtınalarda ve yıldırım toplarında plazma vardır), ancak okul derslerinde plazmanın kimyası neredeyse dikkate alınmaz. 
Maddeler saf olabilir, çok saf olabilir (örneğin, fiber optik oluşturmak için gerekli), gözle görülür miktarda yabancı madde içerebilir veya karışımlar olabilir.
Tüm maddeler atom adı verilen çok küçük parçacıklardan oluşur. Aynı cins atomlardan oluşan maddeler(bir elementin atomlarından), basit denir(örneğin kömür, oksijen, nitrojen, gümüş vb.). Farklı elementlerin birbirine bağlı atomlarını içeren maddelere karmaşık denir.
Bir madde (örneğin hava) iki veya daha fazla basit madde içeriyorsa ve atomları birbirine bağlı değilse, o zaman buna karmaşık madde değil, basit maddelerin karışımı denir. Basit maddelerin sayısı nispeten azdır (yaklaşık beş yüz), ancak karmaşık maddelerin sayısı çok fazladır. Bugüne kadar on milyonlarca farklı karmaşık madde bilinmektedir. 
Kimyasal dönüşümler
Maddeler birbirleriyle etkileşime girebilir ve yeni maddeler ortaya çıkar. Bu tür dönüşümlere denir kimyasal. Örneğin, basit bir madde olan kömür, başka bir basit madde olan oksijenle etkileşime girer (kimyacılar tepkimeye girdiğini söyler), bunun sonucunda karbon ve oksijen atomlarının birbirine bağlı olduğu karmaşık bir madde olan karbondioksit oluşur. Bir maddenin diğerine bu tür dönüşümlerine kimyasal denir. Kimyasal dönüşümler kimyasal reaksiyonlardır. Böylece, şeker havada ısıtıldığında, karmaşık bir tatlı madde olan sakkaroz (şekerin yapıldığı) basit bir maddeye - kömüre ve karmaşık bir madde - suya dönüşür.
Kimya bir maddenin diğerine dönüşümünü inceler. Kimyanın görevi, belirli bir maddenin belirli koşullar altında hangi maddelerle etkileşime girebileceğini (reaksiyona girebileceğini) ve neyin oluştuğunu bulmaktır. Ayrıca belirli bir dönüşümün hangi koşullar altında meydana gelebileceğini ve istenilen maddenin elde edilebileceğini bulmak da önemlidir.
Maddelerin fiziksel özellikleri
Her madde bir dizi fiziksel ve kimyasal özellik ile karakterize edilir. Fiziksel özellikler, fiziksel araçlar kullanılarak karakterize edilebilecek özelliklerdir.. Örneğin termometre kullanarak suyun erime ve kaynama noktalarını belirleyebilirsiniz. Bir maddenin elektrik akımı iletme yeteneğini karakterize etmek, maddenin yoğunluğunu, sertliğini vb. belirlemek için fiziksel yöntemler kullanılabilir. Fiziksel işlemler sırasında maddelerin bileşimi değişmeden kalır.
Maddelerin fiziksel özellikleri sayılabilir (belirli fiziksel araçlar kullanılarak sayıyla karakterize edilebilenler, örneğin yoğunluk, erime ve kaynama noktaları, sudaki çözünürlük vb. belirtilerek) ve sayısız (şu şekilde karakterize edilemeyenler) olarak ikiye ayrılır: sayı veya çok zor - renk, koku, tat vb. gibi).
Maddelerin kimyasal özellikleri
Bir maddenin kimyasal özellikleri, başka hangi maddelerin ve belirli bir maddenin hangi koşullar altında kimyasal etkileşimlere girdiği hakkında bir dizi bilgidir.. Kimyanın en önemli görevi maddelerin kimyasal özelliklerini belirlemektir.
Kimyasal dönüşümler, maddelerin en küçük parçacıklarını (atomları) içerir. Kimyasal dönüşümler sırasında bazı maddelerden başka maddeler oluşur ve orijinal maddeler kaybolur, yerlerine yeni maddeler (reaksiyon ürünleri) oluşur. A atomlar herkes kimyasal dönüşümler korunur. Yeniden düzenlenmeleri meydana gelir; kimyasal dönüşümler sırasında atomlar arasındaki eski bağlar yok edilir ve yeni bağlar ortaya çıkar.
Kimyasal element
Farklı maddelerin sayısı çok fazladır (ve her birinin kendine özgü fiziksel ve kimyasal özellikleri vardır). Çevremizdeki maddi dünyada, en önemli özellikleri bakımından birbirinden farklı olan nispeten az sayıda atom vardır - yaklaşık yüz. Her atom tipinin kendine ait kimyasal elementi vardır. Kimyasal element aynı veya benzer özelliklere sahip atomların topluluğudur. Doğada yaklaşık 90 farklı kimyasal element bulunur. Bugüne kadar fizikçiler Dünya'da bulunmayan yeni atom türleri yaratmayı öğrendiler. Bu tür atomlara (ve buna göre bu tür kimyasal elementlere) yapay (İngilizce - insan yapımı elementler) denir. Bugüne kadar iki düzineden fazla yapay olarak elde edilen element sentezlendi.
Her elementin Latince bir adı ve bir veya iki harfli sembolü vardır. Rusça kimya literatüründe, kimyasal elementlerin sembollerinin telaffuzuna ilişkin açık kurallar yoktur. Bazıları bunu şu şekilde telaffuz ediyor: elementi Rusça olarak adlandırıyorlar (sodyum, magnezyum vb. sembolleri), diğerleri - Latin harfleriyle (karbon, fosfor, kükürt sembolleri), diğerleri - elementin adının Latince'de neye benzediğini söylüyorlar (demir, gümüş, altın, cıva). Genellikle hidrojen H elementinin sembolünü Fransızcada bu harfin okunduğu şekilde telaffuz ediyoruz.
Kimyasal elementlerin ve basit maddelerin en önemli özelliklerinin karşılaştırması aşağıdaki tabloda verilmiştir. Bir element birkaç basit maddeye (alotropi fenomeni: karbon, oksijen vb.) veya belki de sadece bir tanesine (argon ve diğer inert gazlar) karşılık gelebilir.

İnorganik maddelerin sınıflandırılması ve isimlendirilmesi, zaman içinde en basit ve en sabit karakteristiklere dayanmaktadır: kimyasal bileşim Belirli bir maddeyi oluşturan elementlerin atomlarını sayısal oranlarında gösterir. Bir madde bir kimyasal elementin atomlarından oluşuyorsa; bu elementin serbest formdaki varoluş şeklidir, o zaman buna basit denir madde; Madde iki veya daha fazla elementin atomlarından oluşuyorsa buna denir. karmaşık madde. Tüm basit maddelere (tek atomlu olanlar hariç) ve tüm karmaşık maddelere genellikle denir. kimyasal bileşiklerçünkü içlerinde bir veya farklı elementlerin atomları birbirine kimyasal bağlarla bağlanır.
İnorganik maddelerin isimlendirilmesi formüllerden ve isimlerden oluşur. Kimyasal formül - kimyasal elementlerin sembolleri, sayısal endeksler ve diğer bazı işaretler kullanılarak bir maddenin bileşiminin tasviri. Kimyasal ad - bir kelime veya kelime grubu kullanılarak bir maddenin bileşiminin görüntüsü. Kimyasal formüllerin ve isimlerin yapısı sistem tarafından belirlenir isimlendirme kuralları.
Kimyasal elementlerin sembolleri ve isimleri Periyodik Element Tablosunda D.I. Mendeleev. Elementler geleneksel olarak ikiye ayrılır. metaller Ve ametaller . Metal olmayanlar, grup VIIIA'nın (soy gazlar) ve grup VIIA'nın (halojenler) tüm elemanlarını, grup VIA'nın elemanlarını (polonyum hariç), nitrojen, fosfor, arsenik (VA grubu) elemanlarını içerir; karbon, silikon (IVA grubu); bor (IIIA grubu) ve hidrojen. Geriye kalan elementler metal olarak sınıflandırılır.
Maddelerin adlarını derlerken, genellikle dioksijen, ksenon diflorür, potasyum selenat gibi elementlerin Rusça adları kullanılır. Geleneksel olarak, bazı elementler için Latince adlarının kökleri türev terimlere dönüştürülür:
Örneğin: karbonat, manganat, oksit, sülfit, silikat.
Başlıklar basit maddeler tek bir kelimeden oluşur - sayısal bir öneke sahip bir kimyasal elementin adı, örneğin:
Aşağıdakiler kullanılır sayısal önekler:
Belirsiz bir sayı, sayısal bir önekle gösterilir N- poli.
Bazı basit maddeler için de kullanıyorlar özel O 3 - ozon, P 4 - beyaz fosfor gibi isimler.
Kimyasal formüller karmaşık maddeler atamadan oluşur elektropozitif(koşullu ve gerçek katyonlar) ve elektronegatif(koşullu ve gerçek anyonlar) bileşenler, örneğin CuSO 4 (burada Cu 2+ gerçek bir katyondur, SO 4 2 - gerçek bir anyondur) ve PCl 3 (burada P +III koşullu bir katyondur, Cl -I bir koşullu anyon).
Başlıklar karmaşık maddeler sağdan sola kimyasal formüllere göre oluşturulmuştur. İki kelimeden oluşurlar - elektronegatif bileşenlerin adları (aday durumda) ve elektropozitif bileşenlerin (genital durumda) adları, örneğin:
CuS04 - bakır(II) sülfat
PCl 3 - fosfor triklorür
LaCl3 - lantan(III) klorür
CO - karbon monoksit
İsimlerdeki elektropozitif ve elektronegatif bileşenlerin sayısı, yukarıda verilen sayısal öneklerle (evrensel yöntem) veya oksidasyon durumlarıyla (formülle belirlenebiliyorsa) parantez içinde Romen rakamları kullanılarak (artı işareti atlanır) gösterilir. Bazı durumlarda iyonların yükü (karmaşık bileşimdeki katyonlar ve anyonlar için) uygun işaretli Arap rakamları kullanılarak verilir.
Yaygın çok elementli katyonlar ve anyonlar için aşağıdaki özel isimler kullanılır:
|
H 2 F + - floronyum |
C 2 2 - - asetilenit |
|
H3O + - oksonyum |
CN - - siyanür |
|
H 3 S + - sülfonyum |
CNO - - fulminat |
|
NH 4 + - amonyum |
HF 2 - - hidrodiflorür |
|
N2H5+ - hidrazinyum(1+) |
HO 2 - - hidroperoksit |
|
N2H6+ - hidrazinyum(2+) |
HS - - hidrosülfür |
|
NH3OH + - hidroksilamin |
N 3 - - azid |
|
NO+ - nitrosil |
NCS - - tiyosiyanat |
|
NO 2 + - nitroil |
O 2 2 - - peroksit |
|
O2 + - dioksijenil |
O 2 - - süperoksit |
|
PH 4 + - fosfonyum |
O 3 - - ozonit |
|
VO 2+ - vanadil |
OCN - - siyanat |
|
UO 2+ - uranil |
OH - - hidroksit |
Az sayıda iyi bilinen madde için de kullanılır özel başlıklar:
1. Asidik ve bazik hidroksitler. Tuzlar
Hidroksitler, bazı E elementlerinin (flor ve oksijen hariç) atomlarını ve OH hidroksil gruplarını içeren bir tür karmaşık maddedir; hidroksitlerin genel formülü E(OH) N, Nerede N= 1÷6. Hidroksitlerin formu E(OH) N isminde orto-şekil; en N> 2 hidroksit de bulunabilir meta-form, E atomlarına ve OH gruplarına ek olarak oksijen atomları O'yu içerir, örneğin E(OH) 3 ve EO(OH), E(OH) 4 ve E(OH) 6 ve EO 2 (OH) 2 .
Hidroksitler zıt kimyasal özelliklere sahip iki gruba ayrılır: asidik ve bazik hidroksitler.
Asidik hidroksitler stokiyometrik değerlik kuralına tabi metal atomları ile değiştirilebilen hidrojen atomları içerir. Çoğu asit hidroksit bulunur meta-form ve asidik hidroksitlerin formüllerindeki hidrojen atomlarına ilk sırayı verilir, örneğin H2SO4, HNO3 ve H2C03, SO2 (OH)2, NO2 (OH) ve CO ( değil) OH) 2. Asit hidroksitlerin genel formülü H'dir X EO en burada elektronegatif bileşen EO yx - asit kalıntısı denir. Hidrojen atomlarının tümü bir metalle değiştirilmezse asit kalıntısının bir parçası olarak kalırlar.
Yaygın asit hidroksitlerin isimleri iki kelimeden oluşur: “aya” ile biten özel isim ve “asit” grup kelimesi. Yaygın asit hidroksitlerin ve bunların asidik kalıntılarının formülleri ve özel adları aşağıda verilmiştir (çizgi, hidroksitin serbest formda veya asidik sulu çözeltide bilinmediği anlamına gelir):
|
asit hidroksit |
asit kalıntısı |
|
HAsO 2 - metaarsenik |
AsO 2 - - metaarsenit |
|
H3 AsO3 - ortoarsenik |
AsO 3 3 - - ortoarsenit |
|
H3 AsO4 - arsenik |
AsO 4 3 - - arsenat |
|
B 4 O 7 2 - - tetraborat |
|
|
ВiО 3 - - bizmutat |
|
|
HBrO - bromür |
BrO - - hipobromit |
|
HBrO 3 - bromlu |
BrO 3 - - bromat |
|
H 2 CO 3 - kömür |
CO 3 2 - - karbonat |
|
HClO - hipokloröz |
ClO- - hipoklorit |
|
HClO2 - klorür |
ClO2 - - klorit |
|
HClO3 - klorik |
ClO3 - - klorat |
|
HClO 4 - klor |
ClO4 - - perklorat |
|
H 2 CrO 4 - krom |
CrO 4 2 - - kromat |
|
НCrO 4 - - hidrokromat |
|
|
H 2 Cr 2 O 7 - dikromik |
Cr2072 - - dikromat |
|
FeO4 2 - - ferrat |
|
|
HIO 3 - iyot |
IO3 - - iyodat |
|
HIO 4 - metaiyodin |
IO4 - - metaperiyodat |
|
H 5 IO 6 - ortoiyodin |
IO 6 5 - - ortoperiyodat |
|
HMnO 4 - manganez |
MnO4- - permanganat |
|
MnO 4 2 - - manganat |
|
|
MoO4 2 - - molibdat |
|
|
HNO 2 - azotlu |
NO 2 - - nitrit |
|
HNO 3 - nitrojen |
NUMARA 3 - - nitrat |
|
HPO 3 - metafosforik |
PO 3 - - metafosfat |
|
H3PO4 - ortofosforik |
PO 4 3 - - ortofosfat |
|
НPO 4 2 - - hidroortofosfat |
|
|
H2PO4 - - dihidrootofosfat |
|
|
H4P207 - difosforik |
P 2 Ç 7 4 - - difosfat |
|
ReO4 - - perhenate etmek |
|
|
SO 3 2 - - sülfit |
|
|
HSO3 - - hidrosülfit |
|
|
H 2 SO 4 - sülfürik |
SO 4 2 - - sülfat |
|
HSO4 - - hidrojen sülfat |
|
|
H 2 S 2 O 7 - disülfür |
S 2 Ö 7 2 - - disülfat |
|
H 2 S 2 O 6 (O 2) - peroksodisülfür |
S 2 Ö 6 (O 2) 2 - - peroksodisülfat |
|
H 2 SO 3 S - tiyosülfür |
SO3S2 - - tiyosülfat |
|
H 2 SeO 3 - selenyum |
SeO3 2 - - selenit |
|
H 2 SeO 4 - selenyum |
SeO4 2 - - selenat |
|
H2SiO3 - metasilikon |
SiO 3 2 - - metasilikat |
|
H 4 SiO 4 - ortosilikon |
SiO 4 4 - - ortosilikat |
|
H 2 TeO 3 - tellürik |
TeO3 2 - - tellürit |
|
H 2 TeO 4 - metatelürik |
TeO 4 2 - - metatellürat |
|
H 6 TeO 6 - ortotellürik |
TeO 6 6 - - ortotellürat |
|
SES 3 - - metavanadat |
|
|
SÖ 4 3 - - ortovanadat |
|
|
WO 4 3 - - tungstat |
Daha az yaygın olan asit hidroksitler, karmaşık bileşiklerin isimlendirme kurallarına göre adlandırılır, örneğin:
Asit kalıntılarının isimleri tuzların isimlerini oluşturmak için kullanılır.
Temel hidroksitler stokiyometrik değerlik kuralına tabi olarak asidik kalıntılarla değiştirilebilen hidroksit iyonları içerir. Tüm bazik hidroksitler bulunur orto-şekil; genel formülleri M(OH)'dir N, Nerede N= 1,2 (daha az sıklıkla 3,4) ve M N+ bir metal katyonudur. Bazik hidroksitlerin formüllerine ve adlarına örnekler:
Bazik ve asidik hidroksitlerin en önemli kimyasal özelliği birbirleriyle etkileşime girerek tuz oluşturmalarıdır ( tuz oluşumu reaksiyonu), Örneğin:
Ca(OH)2 + H2S04 = CaS04 + 2H20
Ca(OH)2 + 2H2S04 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Tuzlar, M katyonları içeren bir tür karmaşık maddedir. N+ ve asidik kalıntılar*.
Genel formül M olan tuzlar X(EO en)N isminde ortalama tuzlar ve ikame edilmemiş hidrojen atomlu tuzlar - ekşi tuzlar. Bazen tuzlar ayrıca hidroksit ve/veya oksit iyonları da içerir; bu tür tuzlara denir ana tuzlar. İşte tuzların örnekleri ve isimleri:
|
Kalsiyum ortofosfat |
|
|
Kalsiyum dihidrojen ortofosfat |
|
|
Kalsiyum hidrojen fosfat |
|
|
Bakır(II) karbonat |
|
|
Cu2C03(OH)2 |
Dibakır dihidroksit karbonat |
|
Lantan(III) nitrat |
|
|
Titanyum oksit dinitrat |
Asit ve bazik tuzlar, uygun bazik ve asidik hidroksit ile reaksiyona sokularak orta tuzlara dönüştürülebilir, örneğin:
Ca(HSO4)2 + Ca(OH) = CaS04 + 2H20
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
İki farklı katyon içeren tuzlar da vardır: bunlara genellikle denir. çift tuzlar, Örneğin:
2. Asidik ve bazik oksitler
Oksitler E X HAKKINDA en- hidroksitlerin tamamen dehidrasyonundan elde edilen ürünler:
Asit hidroksitler (H 2 SO 4, H 2 CO 3) asit oksitler cevap(S03, CO2) ve bazik hidroksitler (NaOH, Ca(OH)2) - temeloksitler(Na 2 O, CaO) ve E elementinin oksidasyon durumu, hidroksitten okside geçerken değişmez. Formüllere ve oksit adlarına örnek:
Asidik ve bazik oksitler, zıt özelliklere sahip hidroksitlerle veya birbirleriyle etkileşime girdiğinde karşılık gelen hidroksitlerin tuz oluşturucu özelliklerini korur:
N205 + 2NaOH = 2NaNO3 + H20
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H20
La 2 Ö 3 + 3SO 3 = La 2 (S04) 3
3. Amfoterik oksitler ve hidroksitler
Amfoterlik hidroksitler ve oksitler - örneğin alüminyum hidroksit ve alüminyum oksit için iki sıra tuz oluşumundan oluşan kimyasal bir özellik:
(a) 2Al(OH)3 + 3SO3 = Al2(S04)3 + 3H20
Al 2 O 3 + 3H 2 SO 4 = Al 2 (S04) 3 + 3H 2 O
(b) 2Al(OH)3 + Na20 = 2NaAlO2 + 3H20
Al203 + 2NaOH = 2NaAlO2 + H20
Böylece, (a) reaksiyonlarındaki alüminyum hidroksit ve oksit, aşağıdaki özellikleri sergiler: ana hidroksitler ve oksitler, yani. asidik hidroksitler ve oksit ile reaksiyona girerek karşılık gelen tuz - alüminyum sülfat Al 2 (S04) 3'ü oluştururken, (b) reaksiyonlarında da aynı özellikleri sergilerler asidik hidroksitler ve oksitler, yani. bazik hidroksit ve oksit ile reaksiyona girerek bir tuz - sodyum dioksoalüminat (III) NaAlO2 oluşturur. İlk durumda, alüminyum elementi bir metalin özelliğini gösterir ve elektropozitif bileşenin (Al 3+) bir parçasıdır, ikincisinde - metal olmayanın özelliği ve tuz formülünün elektronegatif bileşeninin bir parçasıdır ( AlO2-).
Bu reaksiyonlar sulu bir çözeltide meydana gelirse, ortaya çıkan tuzların bileşimi değişir, ancak katyon ve anyondaki alüminyumun varlığı kalır:
2Al(OH)3 + 3H2S04 = 2 (S04)3
Al(OH)3 + NaOH = Na
Burada, kompleks iyonlar 3+ - heksaaqualuminium(III) katyonu, - - tetrahidroksoalüminat(III) iyonu köşeli parantez içinde vurgulanmıştır.
Bileşiklerde metalik ve metalik olmayan özellikler sergileyen elementlere amfoterik denir; bunlar Periyodik Tablonun A gruplarının elementlerini içerir - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, vb. yanı sıra B- gruplarının çoğu elementi - Cr, Mn, Fe, Zn, Cd, Au, vb. Amfoterik oksitlere bazik oksitlerle aynı denir, örneğin:
Amfoterik hidroksitler (elementin oksidasyon durumu + II'yi aşarsa) şu şekilde bulunabilir: orto- veya (ve) meta- biçim. Amfoterik hidroksitlerin örnekleri şunlardır:
Amfoterik oksitler her zaman amfoterik hidroksitlere karşılık gelmez, çünkü ikincisini elde etmeye çalışırken hidratlı oksitler oluşur, örneğin:
Bir bileşikteki amfoterik elementin birden fazla oksidasyon durumu varsa, karşılık gelen oksitlerin ve hidroksitlerin amfoterisitesi (ve dolayısıyla elementin kendisinin amfoterisitesi) farklı şekilde ifade edilecektir. Düşük oksidasyon durumları için, hidroksitler ve oksitler temel özelliklerin baskınlığına sahiptir ve elementin kendisi metalik özelliklere sahiptir, bu nedenle neredeyse her zaman katyonların bileşimine dahil edilir. Yüksek oksidasyon durumları için, aksine, hidroksitler ve oksitler asidik özelliklere sahiptir ve elementin kendisi metalik olmayan özelliklere sahiptir, bu nedenle neredeyse her zaman anyonların bileşimine dahil edilir. Bu nedenle, manganez(II) oksit ve hidroksit baskın temel özelliklere sahiptir ve manganezin kendisi 2+ tipi katyonların bir parçası iken, manganez(VII) oksit ve hidroksit baskın asidik özelliklere sahiptir ve manganezin kendisi MnO4'ün bir parçasıdır - anyon yazın. Asidik özelliklerin yüksek oranda baskın olduğu amfoterik hidroksitlere, asidik hidroksitlerden sonra modellenen formüller ve isimler atanır, örneğin HMn VII O4 - manganez asit.
Dolayısıyla elementlerin metallere ve metal olmayanlara bölünmesi şarta bağlıdır; Tamamen metalik özelliklere sahip elementler (Na, K, Ca, Ba vb.) ile tamamen metalik olmayan özelliklere sahip elementler (F, O, N, Cl, S, C vb.) arasında büyük bir grup vardır. Amfoterik özelliklere sahip elementlerin
4. İkili bileşikler
İnorganik kompleks maddelerin geniş bir türü ikili bileşiklerdir. Bunlar, her şeyden önce tüm iki elementli bileşikleri (bazik, asidik ve amfoterik oksitler hariç), örneğin H2O, KBr, H2S, Cs2 (S2), N2O, NH3, HN'yi içerir. 3, CaC2, SiH4. Bu bileşiklerin formüllerinin elektropozitif ve elektronegatif bileşenleri, aynı elementin tek tek atomlarını veya bağlı atom gruplarını içerir.
Bileşenlerinden birinin birkaç elementin ilgisiz atomlarını ve ayrıca tek elementli veya çok elementli atom gruplarını (hidroksitler ve tuzlar hariç) içerdiği formüllerdeki çok elementli maddeler, örneğin CSO, IO 2 F3, SBrO2F, CrO (O2)2, PSI3, (CaTi)O3, (FeCu)S2, Hg(CN)2, (PF3)2O, VCl2 (NH2). Dolayısıyla CSO, bir kükürt atomunun bir oksijen atomu ile değiştirildiği bir CS2 bileşiği olarak temsil edilebilir.
İkili bileşiklerin adları olağan terminoloji kurallarına göre oluşturulur, örneğin:
|
OF 2 - oksijen diflorür |
K 2 O 2 - potasyum peroksit |
|
HgCl2 - cıva(II) klorür |
Na2S - sodyum sülfür |
|
Hg 2 Cl 2 - dicıva diklorür |
Mg3 N2 - magnezyum nitrür |
|
SBr 2 O - kükürt oksit-dibromür |
NH 4 Br - amonyum bromür |
|
N 2 O - dinitrojen oksit |
Pb(N 3) 2 - kurşun(II) azid |
|
NO 2 - nitrojen dioksit |
CaC 2 - kalsiyum asetilenit |
Bazı ikili bileşikler için, listesi daha önce verilmiş olan özel isimler kullanılır.
İkili bileşiklerin kimyasal özellikleri oldukça çeşitlidir, bu nedenle genellikle anyonların adıyla gruplara ayrılırlar; halojenürler, kalkojenitler, nitrürler, karbürler, hidritler vb. ayrı ayrı ele alınır.İkili bileşikler arasında diğer inorganik madde türlerinin bazı özelliklerine sahip olanlar da vardır. Bu nedenle, adları oksit kelimesi kullanılarak oluşturulan CO, NO, NO2 ve (Fe II Fe2 III) O4 bileşikleri oksitler (asidik, bazik, amfoterik) olarak sınıflandırılamaz. Karbon monoksit CO, nitrojen monoksit NO ve nitrojen dioksit NO 2 karşılık gelen asit hidroksitlere sahip değildir (her ne kadar bu oksitler metal olmayan C ve N tarafından oluşturulsa da) ve anyonları C II, N II ve N atomlarını içeren tuzlar da oluşturmazlar. IV. Çift oksit (Fe II Fe 2 III) O 4 - diiron(III)-demir(II) oksit, amfoterik elementin atomlarını içermesine rağmen - elektropozitif bileşende demir, ancak bunun sonucunda iki farklı oksidasyon durumunda asit hidroksitlerle etkileşime girdiğinde bir değil iki farklı tuz oluşturur.
AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl ve Pb(N 3) 2 gibi ikili bileşikler, tuzlar gibi gerçek katyonlardan ve anyonlardan oluşturulur ve bu nedenle bunlara denir. tuz benzeri ikili bileşikler (veya basitçe tuzlar). HF, HC1, HBr, H2S, HCN ve HN3 bileşiklerindeki hidrojen atomlarının ikamesinin ürünleri olarak düşünülebilirler. Sulu bir çözeltideki ikincisi asidik bir fonksiyona sahiptir ve bu nedenle çözeltilerine asitler denir, örneğin HF (su) - hidroflorik asit, H2S (su) - hidrosülfür asit. Ancak asit hidroksitlerin türüne ait olmadıkları gibi türevleri de inorganik maddeler sınıfına giren tuzlara ait değildir.